BiblioM@il Renal mayo 2022

Búsqueda bibliográfica sobre síndrome de desgaste proteico energético en la enfermedad renal crónica.
ÍNDICES DE CONTENIDOS:
-Intradialytic nutrition and quality of life in Chilean older patients in hemodialysis with protein‑energy wasting.
Nutrición intradialítica y calidad de vida en pacientes chilenos mayores en hemodiálisis con desgaste proteico-energético.
- Bioelectrical impedance analysis-derived phase angle as a determinant of protein energy wasting and frailty in maintenance hemodialysis patients: retrospective cohort study.
Ángulo de fase derivado del análisis de impedancia bioeléctrica como determinante del desgaste proteico-energético y la fragilidad en pacientes con hemodiálisis de mantenimiento: estudio de cohorte retrospectivo.
- Predicational ability of phase angle on protein energy wasting in kidney disease patients with renal replacement therapy: A cross-sectional study.
Capacidad predictiva del ángulo de fase sobre la pérdida de energía proteica en pacientes con enfermedad renal con terapia de reemplazo renal: un estudio transversal.
Intradialytic nutrition and quality of life in Chilean older patients in hemodialysis with protein‑energy wasting .
Nutrición intradialítica y calidad de vida en pacientes chilenos mayores en hemodiálisis con desgaste proteico-energético.
Autores: Mariana Ayala; Margarita Marchant ; Cristina Hertz ; Gloria Castillo
International Urology and Nephrology. https://doi.org/10.1007/s11255-021-03077-1
Justificación:
Pocos estudios han evaluado el efecto de la suplementación nutricional oral intradiálisis (ONS) sobre la calidad de vida en pacientes mayores en hemodiálisis.
En un estudio observacional prospectivo, las tasas más altas de albúmina sérica y las tasas de hospitalización más bajas a 1 año se asociaron con la administración de ONS. Igualmente, se ha observado que la mitigación del catabolismo se extiende después del final de la diálisis. La ingesta de suplementos orales o alimentos y bebidas ricos en proteínas, durante la primera hora de diálisis, reduce el catabolismo promovido por el proceso de diálisis.
Por otra parte, existe evidencia de que la ONS mejora los marcadores nutricionales, ayuda a mantener un equilibrio positivo de aminoácidos durante la hemodiálisis (HD).
Los estudios observacionales han reportado una relación entre el estado nutricional deficiente y la disminución de la calidad de vida (CdV) en pacientes con HD, los pacientes desnutridos tuvieron puntuaciones más pobres en casi todas las dimensiones de la CdV y se ha identificado una asociación entre las puntuaciones más altas de desnutrición-inflamación y el empeoramiento de la CdV.
También se ha descrito que la desnutrición por sí sola puede causar un estado inflamatorio y conducir a un balance negativo de nitrógeno, pérdida de peso y anorexia, lo que lleva al síndrome del complejo desnutrición-inflamación. Se observaron correlaciones negativas significativas entre todos los aspectos de la calidad de vida y las puntuaciones de desnutrición-inflamación .
Considerando lo anterior, este estudio investiga si la administración de ONS durante 3 meses durante la primera hora de diálisis afectaría la calidad de vida y el estado nutricional en pacientes en HD diagnosticados con desnutrición proteico energética (PEW).
Métodos:
Se realizó un estudio cuasi-experimental antes y después de 3 meses de suplementación nutricional oral intradialítica en 109 pacientes mayores en hemodiálisis.
Se midió en ambos momentos, la puntuación de calidad de vida, la carga de enfermedad renal, tres escalas de calidad de vida y el estado de salud mental y física utilizando KDQoL-SF™ 1.3, composición corporal y parámetros bioquímicos de la condición nutricional.
Inicialmente se preparó una lista de 346 pacientes en regímenes de hemodiálisis 3 veces a la semana de 4 centros de diálisis nephrocare en Santiago de Chile y luego a cada miembro se le asignó un número específico.
De esta población, se eligieron mediante software generador de números aleatorios a 145 pacientes, de los cuales 121 pacientes cumplieron con los criterios de inclusión. Doce pacientes abandonaron voluntariamente su participación antes del final del estudio.
Finalmente, un total de 109 participantes completaron el estudio, que es la población utilizada para el análisis y presentación de resultados.
Los criterios de inclusión para la participación en el estudio fueron: HD durante al menos 3 meses, diagnóstico confirmado de PEW, no hospitalizaciones recientes, consciente y capaz de seguir instrucciones, y capacidad de deglución intacta.
Pacientes con diálisis inadecuada [eKt/V < 1.2], presencia de marcapasos cardíaco [incompatible con las mediciones de BCM], embarazo, diálisis incidente, diagnóstico de insuficiencia hepática, cáncer recidivante o de novo, vasculitis, endocarditis, osteomielitis, diabéticos con gastroparesia o síntomas de enteropatía, cirugía mayor en los últimos 6 meses, suplementación nutricional o nutrición enteral completa en los últimos 3 meses, fueron excluidos del estudio.
Diseño del estudio
Este fue un diseño de estudio cuasi-experimental pre-prueba post-prueba donde cada paciente sirve como su propio control.
Se evaluó el impacto en la calidad de vida y el estado nutricional de 3 meses de ONS intradiálisis en pacientes en HD diagnosticados con PEW.
Como parte de la atención de rutina, todos los pacientes recibieron asesoramiento nutricional de un nutricionista durante la sesión de HD.
Se evaluó la ingesta de macro y micronutrientes de 3 días [día de diálisis, día sin diálisis y día de fin de semana]. La determinación del patrón dietético consideró la frecuencia del consumo semanal de alimentos para evitar subestimar la ingesta calórica y energética en el patrón dietético.
La información nutricional se entregó centrada en los beneficios de la ONS intradialítica y las preguntas frecuentes de los pacientes sobre la suplementación (Fig. 1).
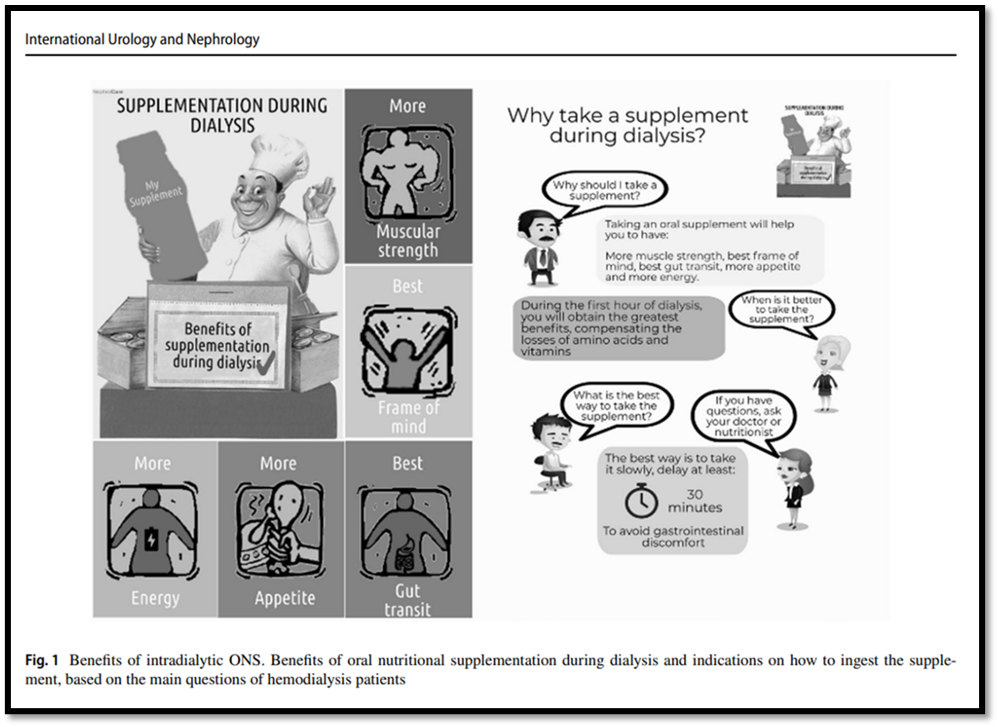
Se evaluó al principio y al final del estudio; Indicadores bioquímicos y de composición corporal. Utilizando KDQoL-SF™ 1.3, la carga de enfermedad renal, tres escalas de calidad de vida y el estado de salud mental y física.
Parámetros bioquímicos y de composición corporal
Se realizaron análisis bioquímicos e indicadores de estado nutricional al comienzo del estudio y al mes 3, inmediatamente antes de la HD.
Los datos sobre la composición corporal y el estado de hidratación se recogieron antes de la sesión de HD, al inicio y al final del estudio, mediante análisis espectroscópico de bioimpedancia a 50 frecuencias (5 kHz–1000 MHz), con el sistema Body Composition Monitor (BCM). (Fresenius Medical Care, Deutschland GmbH, Alemania).®
Las mediciones se tomaron utilizando cuatro electrodos convencionales colocados en el paciente en posición supina, aproximadamente 30 minutos antes de cada HD.
Los volúmenes de líquido extracelular e intracelular y el agua corporal total se calcularon a partir del modelo de fluidos. Estos volúmenes de fluido se utilizaron para determinar la sobrecarga de fluido, expresada como valor OH.
El BCM de peso seco se calculó por preponderación menos OH (kg).
El estado nutricional se evaluó mediante las siguientes medidas: albúmina, proteína C reactiva (PCR) normalizada; porcentaje de pérdida involuntaria de peso y parámetros de composición corporal (peso seco, IMC, masa de tejido magro, masa de tejido adiposo, masa de tejido graso, índice de tejido magro, índice de tejido graso, masa relativa de tejido magro, masa relativa de tejido graso).
El diagnóstico de PEW siguió la nomenclatura y los criterios diagnósticos propuestos por Fouque (Tabla 1).
.png)
Para el diagnóstico de PEW se utilizaron datos bioquímicos y de composición corporal de los pacientes obtenidos del registro electrónico EuCliD (European Clinical Database).
ONS intradialítico
Durante la primera hora de HD durante un período de 3 meses, cada paciente recibió 200 ml de un suplemento oral, que consiste en 400 kcal, 20 g de proteína, 15,6 g de lípidos y 45 g de carbohidratos, 3 g de fibra, 12 mg / g de fósforo: relación proteína (Fresubin 2 kcal Drink®; Fresenius Kabi).
Durante el tiempo de suplementación, no se observó ningún síntoma gastrointestinal.
Evaluación de la calidad de vida
Se utilizó la versión digital del formulario KDQoL-SF ™ 1.3 (código QR) para medir la puntuación específica de calidad de vida para la enfermedad renal.
El formulario se administró antes de la sesión de HD al comienzo y al tercer mes de suplementación y se utilizó para evaluar:
(1) lista de síntomas / problemas, efectos de la enfermedad renal, carga de enfermedad renal, estado laboral, función cognitiva, calidad de la interacción social, función sexual, apoyo familiar y de amigos, sueño y apoyo del personal de diálisis
(2) salud general, satisfacción del paciente
(3) función física, papel de las limitaciones físicas, dolor, salud general, bienestar emocional, papel de las limitaciones emocionales, interacción social, energía / fatiga
(4) compuesto de salud física y compuesto de salud mental. Utilizando el manual de puntuación, se utilizaron los siguientes rangos de puntuación para clasificar cada componente de la calidad de vida: (i) completamente inapropiado [puntuación 0-20]; ii) inapropiado [puntuación 20–40]; iii) baja [puntuación 40–60]; iv) [puntuación 60–80] adecuada; (v) completamente apropiado (puntuación 80–100).
Análisis estadístico
El parámetro principal de este estudio es la calidad de vida y el segundo parámetro es el estado nutricional, evaluado como cambios en la puntuación de calidad de vida e indicadores nutricionales (composición corporal y bioquímicos), respectivamente, desde el inicio hasta el mes 3.
La puntuación de calidad de vida se muestra descriptivamente como la media de la puntuación porcentual y el error estándar con una puntuación de 100 que indica una mejora en la calidad de vida.
La mejoría en el estado nutricional se definió como un cambio significativo con respecto a las mediciones basales de cualquiera de los siguientes parámetros: nPCR, albúmina sérica, IMC y porcentaje de pérdida de peso involuntaria.
La distribución de los datos se analizó mediante la prueba de Kolmogorov-Smirnov.
Las comparaciones entre variables se realizaron mediante la prueba T pareada o la prueba U de Mann-Whitney, dependiendo de la distribución de los datos. El tamaño de la muestra se basó en las concentraciones de albúmina, considerando una variación máxima del 5% para la detección de una diferencia de medias en los niveles de albúmina de ≥ 2,5 g/L con una probabilidad del 95% y α = 0,05.
Todas las pruebas estadísticas se realizaron con el paquete estadístico SPSS 17.0 [SPSS, Inc., Chicago, IL y USA].
La significación estadística se definió como p < 0,05. Los datos se muestran como la media y el error o desviación estándar.
Resultados
Características basales del paciente
La población del estudio comprendió 109 participantes diagnosticados con PEW. Participaron un 59% de hombres y un 41% de mujeres, la edad media fue de 69,4 ± 3,4 años (75,2% mayores de 66 años), el 35,8% tenía diabetes tipo 2 y la duración media de la EH fue de 63,5 ± 52,6 meses, la adecuación de la diálisis OCMKt/V y eKt/V se mantuvo en el rango óptimo durante todo el estudio.
Las principales causas de insuficiencia renal fueron anomalías glomerulares en diabetes tipo 2 (n = 39), enfermedad renal hipertensiva (n = 18), enfermedad renal poliquística (n = 4) y causa desconocida (n = 48) (Tabla 2).
.png)
Registros dietéticos
Se observó un aumento significativo en la ingesta de calorías, macronutrientes y micronutrientes.
Al comparar la ingesta entre el inicio y después de 3 meses de suplementación, se observó un aumento significativo en: consumo total de energía (1626.2 ± 328.5 vs. 1856.4 ± 275.4 kcal/día), proteínas (61.4 ± 12.3 vs. 67.5 ± 9.7 g/día), lípidos (50.8 ± 16 vs. 56.4 ± 9.9 g/día) y carbohidratos (230.8 ± 45.6 vs. 269.6 ± 42.9 g/día).
Un aumento significativo en la ingesta de fósforo de 214.5 mg / día (833.1 ± 209.4 vs. 1047.7 ± 300.8 mg / día) se asoció con el aumento neto en la ingesta de proteínas proporcionada por ONS.
En contraste, los niveles de fósforo en la sangre disminuyeron significativamente [consulte la sección de parámetros bioquímicos a continuación].
También se encontraron aumentos significativos en la ingesta dietética de potasio (1919.5 ± 726.5 vs. 2405.7 ± 535.3 mg / día) y calcio (392.2 ± 178.4 vs. 525.2 ± 95.3 mg / día).
La ingesta de sodio (2417,2 ± 977,4 vs. 2345,6 ± 609,8 mg/día) se mantuvo sin cambios significativos en comparación con el valor inicial y después de 3 meses de suplementación.
Parámetros bioquímicos y de composición corporal
Se observaron cambios significativos en los indicadores de estado nutricional y composición corporal.
Se observó una mejoría en uno o más indicadores en el 92% de los pacientes.
Se observó un empeoramiento del estado nutricional en el 8% de los pacientes, comparando el valor basal y el mes 3 de suplementación.
Los niveles séricos de bicarbonato al principio y al final del estudio se mantuvieron en un rango adecuado (22-26 mmol / L), no se observó acidosis metabólica. Sin embargo, se observó una disminución significativa en los niveles séricos de bicarbonato al comparar antes y 3 meses después de la suplementación (Tabla 3).
.png)
Calidad de vida
Todos los pacientes (N = 109) completaron un formulario KDQoL-SF al comienzo del estudio y al tercer mes de suplementación.
Se observó una mejoría significativa en los componentes físicos y mentales de la calidad de vida al comparar el valor basal y el mes 3 de suplementación.
Las puntuaciones de los siguientes componentes aumentaron significativamente; síntomas/problemas, función cognitiva, sexual y social, sueño, dolor, energía/fatiga, salud general y limitaciones físicas, en particular función sexual, salud general, bienestar emocional, sueño, limitaciones funcionales: función emocional y social.
Los siguientes componentes de la calidad de vida aumentaron significativamente desde el rango bajo (40-60%) hasta el rango adecuado (60-80%); función sexual, sueño y función social (Fig. 2).
.png)
Implicaciones para la práctica clínica
Estos datos contribuyen al desarrollo de estrategias para reducir la morbilidad y la mortalidad. El tratamiento y la prevención de la PEW con ONS intradiálisis pueden ayudar a reducir algunas limitaciones físicas y mentales en pacientes con HD.
La evaluación de la calidad de vida es útil para diseñar estrategias de intervención que mejoren el resultado clínico, la adherencia y reduzcan el dolor en pacientes con alto deterioro metabólico.
Discusión
En pacientes mayores, la PEW es una afección subyacente entre la sarcopenia y la fragilidad, que es causada principalmente por una disminución en la ingesta de alimentos y un aumento del catabolismo.
Se han diseñado varios tratamientos para mitigar los síntomas de PEW.
Este estudio indica un beneficio de la ONS intradialítica tanto en la calidad de vida como en los resultados nutricionales en pacientes mayores sin revertir la PEW.
Una gran parte de los pacientes tenían un IMC superior a 23 kg/m2.
Se sabe que el PEW es común en pacientes con sobrepeso y obesidad, por esta razón, para el diagnóstico de PEW, se consideraron al menos tres indicadores de un conjunto de indicadores según Fouque 2008.
Incluso después de una breve administración de ONS durante 3 meses, se observó una mejoría significativa en nueve de los 22 componentes de la CV, tanto físicos como mentales.
Los pacientes que reciben HD a menudo se quejan de dificultad para conciliar el sueño y permanecer dormidos, y las quejas de fatiga son comunes en esta población. La fatiga induce una ingesta proteica y calórica por debajo del 80% de los niveles recomendados para un día de diálisis, lo que afecta negativamente al estado nutricional.
El ONS intradialítico aumentó significativamente la energía / fatiga y las puntuaciones generales de salud, al tiempo que aumentó la ingesta de proteínas y calorías. El cansancio puede dificultar la capacidad de preparar comidas adecuadas y realizar otras actividades de la vida diaria. La reducción de la fatiga se relaciona con una mejor disposición de los pacientes a comer alimentos post-diálisis.
Se sabe que las puntuaciones más bajas en el componente físico y mental de la calidad de vida se asocian con un mayor riesgo de muerte y hospitalización en los próximos 2 años.
Similar a este estudio, Scott et al. encontraron una mejora significativa en las puntuaciones en el componente de rol físico utilizando ONS.
Los resultados de este estudio parecen sugerir un efecto positivo de la ONS intradiálisis sobre los componentes físicos y mentales de la calidad de vida, pero no indicaron cambios significativos en el músculo.
Un hallazgo también reportado por estudios similares ha demostrado que las reservas de proteínas musculares no están determinadas únicamente por la ingesta de nutrientes.
Los programas de actividad física combinados con ONS podrían ser una opción para el fortalecimiento muscular, un efecto reportado después del ejercicio físico en pacientes adultos jóvenes desnutridos.
En pacientes mayores, es difícil implementar actividad física debido a la fragilidad y morbilidad, sin embargo, en la primera etapa, aumentar la ingesta de proteínas y calorías es un tipo de intervención más viable y luego, en la segunda etapa, se podría implementar un programa de actividad física enfocado a recuperar la fuerza muscular.
Los estudios epidemiológicos han demostrado un mayor riesgo de mortalidad entre los pacientes en diálisis afectados por trastornos del sueño.
En este estudio, la puntuación del sueño aumentó significativamente en el mes 3 de la suplementación en comparación con la línea de base, pasando de baja (< 60%) a adecuada (> 60%), junto con la puntuación de la función social aumentada significativamente, lo que en consecuencia podría afectar el bienestar general y el estado de salud mental.
Simultáneamente con una mejor puntuación de CdV, se observó un mejor estado nutricional y un aumento significativo de la albúmina en el mes 3 después de la suplementación. Estos cambios podrían estar asociados con una reducción del 29% en el riesgo de mortalidad.
A pesar del aumento en la ingesta de proteínas, se observó una disminución significativa en los niveles séricos de fósforo, reduciendo el riesgo de hiperfosfatemia, un factor de riesgo de mortalidad en pacientes con HD.
La disminución de los niveles séricos de fósforo podría estar relacionada con una mejor disposición a seguir las indicaciones médicas nutricionales, según el registro dietético y la anamnesis nutricional. Además, se observa una disminución en los niveles séricos de bicarbonato cuando se compara antes y después de la suplementación, relacionada con el aumento en la ingesta calórica de proteínas.
La mayoría de los pacientes en este estudio experimentaron una mejoría en al menos un indicador nutricional.
Sin embargo, se observó un empeoramiento del estado nutricional en un pequeño grupo (8%) de pacientes. Este grupo de pacientes que no respondieron a la intervención DE ONS intradiálisis tenían indicadores de estado nutricional como la reserva de masa muscular por debajo de la recomendada al inicio del estudio y no lograron un aumento de peso significativo al final del período de suplementación.
En este estudio, también se observó un aumento en la masa de tejido adiposo, masa grasa, índice de tejido graso e índice de tejido graso asociado con la ONS intradiálisis, que recientemente se sabe que contribuye a reducir la mortalidad en este grupo de pacientes, tal como se ha observado en varios estudios.
Junto con los cambios en la composición corporal, se observó un mejor control de la ingesta de líquidos, lo que se refleja en una disminución significativa de la OH%. Estudios anteriores han relacionado una mayor ingesta de proteínas y calorías con un mejor estado de hidratación.
Conclusiones
Nuestros hallazgos indican que 3 meses de suplementación nutricional oral intra-diálisis mejoran los componentes de la calidad de vida física y mental y el estado nutricional en pacientes mayores que reciben hemodiálisis diagnosticados con pérdida de energía proteica. Estos resultados son relevantes para mejorar la experiencia de los pacientes con pérdida de energía proteica que reciben hemodiálisis.
Los hallazgos de este estudio indican que la ONS durante la primera hora de diálisis mejora los componentes del estado nutricional y la calidad de vida en pacientes mayores en diálisis diagnosticados con PEW.
Mejorar las capacidades físicas y mentales puede ayudar a mantener la autonomía y mejorar la experiencia de los pacientes con tratamiento de hemodiálisis. Estos resultados son clínicamente relevantes y deben confirmarse con estudios de suplementación a largo plazo.
Limitaciones:
La inclusión de un grupo de control que no recibió ONS ayudaría a aislar mejor el efecto de la suplementación sobre las medidas nutricionales y de calidad de vida. Por razones éticas, no fue posible incluir un grupo de control en este estudio. No se incluyó la identificación del estado psicosocial (p.ej., síntomas de depresión y rasgo de ansiedad), que puede afectar potencialmente la calidad de vida, al comienzo del estudio. Sin embargo, la evaluación de estas condiciones habría requerido el uso de encuestas específicas adicionales que requerirían más tiempo del paciente para completar el cuestionario.
Otra limitación del estudio es que no se pudo medir la proteína C reactiva (PCR), un biomarcador inflamatorio. Sin embargo, encontramos un aumento de la albúmina sérica, lo que podría explicarse por un aumento en el consumo de energía y proteínas después de la intervención.
Se necesita más evidencia de ensayos controlados aleatorios para proporcionar información sobre cómo el apoyo nutricional en pacientes mayores con HD y con PEW mejora la calidad de vida y el estado nutricional.
Referencias
1-Carrero JJ, Thomas F, Nagy K et al (2018) Prevalencia global del desgaste proteico-energético en la enfermedad renal: un meta-análisis de estudios observacionales contemporáneos de la sociedad internacional de nutrición renal y metabolismo. J Renal Nutr 28:380–392. https://doi.org/10.1053/j.jrn.2018.08.006.
2-Ikizler TA, Cano NJ, Franch H et al (2013) Prevención y tratamiento del desperdicio de energía proteica en pacientes con enfermedad renal crónica: una declaración de consenso de la sociedad internacional de nutrición renal y metabolismo. Riñón Int 84(6):1096–1107. https://doi.org/10.1038/ki.2013.147.
3-Sabatino A et al (2016) Desperdicio de proteína-energía y suplementación nutricional en pacientes con enfermedad renal terminal en hemodiálisis. Clin Nutr 36(3):663–671. https://doi.org/10.1016/j.clnu.2016.06.007.
4-Marte JLC, Javier A, Ruiz-MatukCetPaulino-Ramirez R (2019) Calidad de vida y estado nutricional en pacientes diabéticos en hemodiálisis. Diabetes Metab Syndr Clin Res Rev 13(1):576–580. https://doi.org/10.1016/j.dsx.2018.11.020.
5-Daniel SC et al (2020) Examinando la relación entre nutrición, calidad de vida y depresión en pacientes en hemodiálisis. Qual Life Res 30(3):759–768. https://doi.org/10.1007/s11136-020-02684-2.
6-Limwannata P et al (2021) Efectividad de los suplementos nutricionales orales específicos del riñón en comparación con el asesoramiento dietético en pacientes en hemodiálisis desnutridos. Int Urol Nephrol 53(8):1675–1687. https://doi.org/10.1007/s11255-020-02768-5.
7-Scott MK et al (2009) Efectos de los suplementos orales peridialíticos sobre el estado nutricional y la calidad de vida en pacientes en hemodiálisis crónica. J Renal Nutr 19:145–152. https://doi.org/10.1053/j.jrn.2008.08.004.
8-Lacson E Jr et al (2009) Asociados de mortalidad y hospitalización en hemodiálisis: variables de laboratorio potencialmente accionables y acceso vascular. Am J Kidney Dis 53:79–90. https://doi.org/10.1053/j.ajkd.2008.07.031.
9-Rhee CM et al (2018) Dieta baja en proteínas para el tratamiento conservador de la enfermedad renal crónica: una revisión sistemática y un metanálisis de ensayos controlados. J Caquexia sarcopenia muscular 9(2):235–245. https://doi.org/10.1002/jcsm.12264.
Bioelectrical impedance analysis-derived phase angle as a determinant of protein energy wasting and frailty in maintenance hemodialysis patients: retrospective cohort study.
Ángulo de fase derivado del análisis de impedancia bioeléctrica como determinante del desgaste proteico-energético y la fragilidad en pacientes con hemodiálisis de mantenimiento: estudio de cohorte retrospectivo.
Autores: Masakazu Saitoh, Masumi Ogawa, Hisae Kondo, Kiichi Suga, Tetsuya Takahashi, Haruki Itoh and Yoichiro Tabata.
Saitoh et al. BMC Nephrology (2020) 21:438.
Justificación
El ángulo de fase (PA), medido por análisis de impedancia bioeléctrica (BIA) se ha estudiado como indicador del estado nutricional o función muscular en pacientes en hemodiálisis (HD).
No está claro si el ángulo de fase está asociado con el desgaste proteico-energético (PEW) o con la fragilidad, que son complicaciones comunes en pacientes en hemodiálisis.
El objetivo de este estudio fue determinar si el PA derivada de BIA es un marcador de PEW o fragilidad en pacientes en HD.
Introducción
El desgaste proteico-energético (PEW, por sus siglas en inglés), definido como la pérdida de reservas de energía y proteínas corporales somáticas y circulatorias, es una complicación común entre los pacientes en hemodiálisis (HD).
La fragilidad, por otra parte, se puede definir como un síndrome biológico de disminución de la reserva y la resistencia a los factores estresantes que resulta del declive acumulativo en múltiples sistemas fisiológicos y es muy prevalente en pacientes con HD.
Los pacientes en HD acompañados de PEW o fragilidad se asocian con un envejecimiento biológico acelerado y un mayor riesgo de eventos cardiovasculares (CV) y muerte.
Una propuesta más reciente sugiere que la detección temprana y el diagnóstico de PEW y fragilidad son importantes en la práctica clínica entre los pacientes en HD.
El análisis eléctrico de bioimpedancia (BIA) es un método no invasivo, seguro y rápido, y una evaluación validada del estado de hidratación y la composición corporal.
El uso clínico de la BIA en pacientes en HD es cada vez más utilizado en el manejo del peso seco y el estado nutricional.
El PA medido por BIA refleja la resistencia y reacción del cuerpo en respuesta a la aplicación de una corriente externa.
PA es el parámetro de impedancia clínicamente más relevante, un índice de integridad y vitalidad de la membrana celular. El ángulo de fase es una medida directa de BIA y, por lo tanto, no está influenciado por suposiciones que pueden afectar la composición corporal o las evaluaciones de hidratación.
Un nivel más bajo de PA indica una disminución de la integridad celular o muerte celular, mientras que un nivel más alto de PA sugiere grandes cantidades de membranas celulares intactas.
Además, el PA se ha utilizado recientemente como una herramienta para evaluar la progresión de la enfermedad, así como para predecir el resultado clínico en muchas situaciones clínicas.
Sin embargo, la asociación entre PA y PEW o fragilidad sigue siendo incierta entre los pacientes en HD.
Este estudio se centra en pacientes con HD, con el objetivo fundamental de investigar la validez del ángulo de fase en la predicción de PEW y fragilidad, y en segundo lugar para examinar la asociación entre PA y riesgo CV.
Métodos
El presente estudio incluyó a 116 pacientes adultos en HD (35 % mujeres, 64 ± 12 años de edad) de una sola unidad de la Clínica Meisei-kai Toyo Yachimata, Chiba, Japón, entre enero de 2018 y marzo de 2018.
Los pacientes eran elegibles para participar si eran mayores de 18 años, habían recibido HD de mantenimiento al menos 3 veces por semana durante más de 6 meses y no tenían contraindicaciones para BIA, incluidos los pacientes con marcapasos o sin extremidades.
Los criterios de exclusión del presente estudio fueron comorbilidades malignas activas e ingreso hospitalario reciente dentro de los 3 meses que pudieran influir en el estado nutricional o funcional.
Los colaboradores del estudio entrevistaron a los pacientes antes o durante una sesión de HD, obtuvieron datos clínicos y de laboratorio recientes de los registros médicos y midieron la fuerza muscular y el rendimiento físico antes del inicio de la sesión de HD.
Puntuación de riesgo cardiovascular
La puntuación de riesgo cardiovascular (CV) se calculó utilizando un nuevo modelo de riesgo desarrollado por el Estudio de patrones de práctica y resultados de diálisis de Japón (J-DOPPS).
Este modelo de riesgo CV tuvo una asociación dependiente de la dosis más precisa con los eventos CV observados que la puntuación de riesgo de Framingham entre los pacientes en HD.
El modelo de riesgo CV J-DOPPS contenía solo seis variables: edad, diabetes mellitus, antecedentes de eventos CV, tiempo de diálisis por sesión, nivel de fósforo y nivel de albúmina, con un rango de 0 a 20 puntos, y las puntuaciones más altas reflejaban un mayor riesgo de eventos CV.
Diagnóstico del desgaste proteico-energético
La Sociedad Internacional de Nutrición y Metabolismo Renal (ISRNM) recomendó el diagnóstico de PEW. PEW involucra 4 categorías:
(1) química sérica: albúmina sérica baja o colesterol total;
(2) masa corporal: disminución del índice de masa corporal (IMC) o porcentaje de grasa corporal total o pérdida de peso involuntaria,
(3) masa muscular: apariencia de creatinina sérica antes de la diálisis normalizada por el área de superficie corporal (sCr/BSA), y
(4 ) la ingesta dietética normalizó la apariencia de nitrógeno proteico (nPNA). Los valores de corte fueron los siguientes: albúmina sérica, 3,8 g/dL; IMC, 23 kg/m 2 o pérdida de peso no intencionada (5% en 3 meses o 10% en 6 meses); sCr/BSA, 380 µmol/L/ m2 ; y nPNA, 0,8 g/kg por día.
El diagnóstico de DPE se definió en al menos 3 de las 4 categorías enumeradas.
Diagnóstico de fragilidad
La fragilidad se evaluó con base en los criterios de la versión japonesa del Cardiovascular Health Study (J-CHS) que consta de 5 componentes: pérdida de peso, agotamiento, baja actividad física, lentitud y debilidad.
(1) La pérdida de peso se evaluó mediante la pregunta "¿Ha perdido 2 kg o más en los últimos 6 meses?".
(2) El agotamiento se midió con la pregunta: “En las últimas 2 semanas, ¿se ha sentido cansado sin motivo? ”.
(3) La actividad física baja se midió a través de las dos preguntas: “¿Realiza niveles moderados de ejercicio físico o deportes orientados a la salud?” y “¿Realiza niveles bajos de ejercicio físico orientado a la salud?”.
(4) La lentitud se midió utilizando la velocidad de marcha habitual: se pidió a los pacientes que caminaran 5 m a su ritmo cómodo utilizando cualquier ayuda para caminar para mantener el equilibrio y la función.
(5) La debilidad se evaluó midiendo la fuerza de prensión manual en posición sentada. El J-CHS comprende lo siguiente: (1) Pérdida de peso: 1 punto por "sí" a la pregunta; (2) Agotamiento: 1 punto por “sí” a la pregunta; (3) Baja actividad física: 1 punto por “no” a ambas preguntas; (4) Lentitud: 1 punto si la velocidad de la marcha < 1,0 m/s; (5) Debilidad: 1 punto si fuerza de prensión < 26 kg en hombres y < 18 kg en mujeres. Sumando las puntuaciones de J-CHS, calculamos una puntuación total de J-CHS; se utilizó un punto de corte de ≥3 para identificar la fragilidad. mediciones de BIA se realizaron con seca mBCA515 (seca®, Hamburgo, Alemania), que es un dispositivo de bioimpedancia multifrecuencia. El texhniqu de 8 electrodos permite la medición de la impedancia segmentaria del brazo y las piernas. Todos los pacientes estaban en posición de pie.
El PA se calculó utilizando la siguiente ecuación:
PA(grado) = arctan(Xc/R) × (180/ π )), está relacionado con la masa celular corporal y la composición de los tejidos blandos.
Se obtuvieron cuartiles para el PA (25, 3,7°; 50, 4,2°; 75, 5,0), y los pacientes se clasificaron en cuatro grupos: grupo del primer cuartil (PA < 3,7°), grupo del segundo cuartil (3,7 ≤ PA < 4,2 °), grupo del tercer cuartil (4,2 ≤ PA < 5,0°) y grupo del cuarto cuartil (PA ≥ 5,0°).
Para examinar los valores de PA ajustados por edad, sexo e índice de masa corporal, los valores de PA se convirtieron en puntaje sd mediante la siguiente ecuación:
Puntaje de desviación estándar (SDS) = (X – X promedio)/sd
Donde X es el valor observado, X promedio es la media del valor normal a la edad, el sexo y el índice de masa corporal respectivos, y sd es la desviación estándar de la media.
Se registraron los componentes corporales derivados de BIA, como el agua extracelular (ECW), el agua corporal total (TBW), la masa grasa y la masa libre de grasa, y ECW/TBW se calculó mediante la proporción de ECW y TBW.
Análisis estadístico
Las variables continuas se expresan en media ± desviación estándar y como recuentos y porcentajes, según corresponda.
Para la comparación de las variables continuas entre los grupos de AF se utilizó el análisis de varianza de una vía y para las variables categóricas se realizó la prueba de chi-cuadrado de Pearson.
Para ajustar los efectos debido a los posibles factores de confusión de la PA, se realizaron modelos de regresión logística multivariable de PEW y fragilidad, y se determinaron los odds ratios (OR) y los intervalos de confianza del 95 % (IC del 95 %). La PA ≥ 5,0° (grupo del cuarto cuartil) fue considerada la referencia para este análisis. En el análisis del riesgo de eventos CV, comparamos la puntuación del modelo de riesgo de eventos CV entre los grupos de PA mediante la prueba de Kruskal-Wallis.
Los análisis estadísticos se realizaron utilizando el software SPSS, versión 21, y en todos los cálculos estadísticos, una p de dos colas < 0,05 se consideró estadísticamente significativo.
Resultados
La edad media de los pacientes en HD en el análisis fue de 64 ± 12 años; el 35% de los pacientes eran mujeres; la antigüedad de diálisis fue de 7 ± 6 años; La puntuación de PA fue de 4,3 ± 1,1° y la SDS de PA fue de −1,1 ± 1,8; El 65% de los pacientes tenían PA SDS < -1 sd, y el 17% tenían PA SDS entre -1 y 0 sd y el 18% tenían PA SDS > 0 sd.
Las características clínicas de la población de estudio según grupos de PA se muestran en la tabla 1.
.png)
Los pacientes en HD con menor PA eran significativamente mayores, tenían una mayor proporción de mujeres y menor IMC, nivel de creatinina sérica, nivel de albúmina, índice de creatinina modificado y fuerza de prensión manual.
Los hallazgos de este studio demostraron que el 35 % de los pacientes en el grupo del primer cuartil, el 24 % en el grupo del segundo cuartil, el 21 % en el grupo del tercer cuartil y el 3 % en el grupo del cuarto cuartil presentaban PEW según los criterios de la ISRNM ( p = 0,032).
Además, la prevalencia de fragilidad fue del 59 % en el grupo del primer cuartil, del 40 % en el grupo del segundo cuartil, del 21 % en el grupo del tercer cuartil y del 3 % en el grupo del cuarto cuartil ( p < 0,001). Las variables clínicas restantes no fueron significativamente diferentes entre los grupos de PA.
Evaluamos la precisión de predicción de varias variables medidas por BIA. El valor del área bajo la curva (AUC) de un PA es grande para predecir la fragilidad y el PEW en comparación con otros valores medidos por BIA (Tabla 2).
.png)
En la tabla 3 se muestran los resultados del análisis de regresión logística de las variables predictoras relacionadas con el PEW en pacientes en HD.
.png)
El análisis de regresión logística univariable mostró que el grupo del primer cuartil (OR 14,737, IC del 95 % 1,740–124,827, p = 0,014) y el grupo del segundo cuartil (OR 8,909, IC del 95 % 1,019–77,905, p = 0,048) tenían un riesgo significativamente mayor de PEW en comparación con el grupo del cuarto cuartil.
Además, el análisis de regresión logística multivariable mostró que el grupo del primer cuartil seguía siendo un predictor de PEW después de ajustar por otros factores de confusión, en comparación con el grupo del cuarto cuartil (modelo 2: OR 10,967, IC del 95 % 1,124–107,014, p = 0,039; modelo 3: OR 11,099, IC 95% 1,101-111,926, p = 0,041).
La tabla 4 muestra los resultados del análisis de regresión logística de las variables predictoras asociadas a la fragilidad en pacientes en HD.
.png)
En el análisis de regresión logística univariable, el grupo del primer cuartil (OR 40,727, IC del 95 % 4,805–345,219, p = 0,001) y el grupo del segundo cuartil (OR17,111, IC del 95 % 2,031–144,136, p = 0,009) se encontraban en un nivel significativamente mayor riesgo de fragilidad en comparación con el grupo del cuartil 4.
En el análisis multivariado, el grupo del primer cuartil (OR 36,770, IC 95% 3,906-346,140, p = 0,002) y el grupo del segundo cuartil (OR 16,525, IC 95% 1,867-146,285, p = 0,012) siguieron siendo predictores de fragilidad después de ajustar por edad, sexo y antigüedad en HD en comparación con el grupo del cuarto cuartil (modelo 2).
De manera similar, el grupo del primer cuartil (OR 15,612, IC del 95 % 1,194–204,120, p = 0,036) se asoció significativamente con la fragilidad después de ajustar por edad, sexo, antigüedad en HD, diabetes mellitus, nivel de hemoglobina, fuerza de prensión que el grupo del cuarto cuartil ( modelo 3).
La figura 1 muestra la relación entre el PA y los subgrupos de cuatro cuartiles de la puntuación del modelo de riesgo CV entre los pacientes en HD.
El primer cuartil tuvo una puntuación de riesgo CV significativamente mayor en comparación con los grupos del tercer y cuarto cuartil ( p = 0,004 y p < 0,001).
.png)
Discusión
El PEW y la fragilidad son complicaciones comunes asociadas con el deterioro funcional y peor pronóstico en pacientes en HD.
El presente estudio demostró que un PA bajo medido por BIA como una herramienta de detección alternativa simple es un predictor independiente de PEW y fragilidad, así como una puntuación de riesgo CV en pacientes en HD.
El significado biológico del PA sigue siendo incierto; sin embargo, parece reflejar la masa celular del cuerpo o la función de la membrana celular.
El aumento de ECW se asocia con un estado nutricional deficiente y una reducción del agua corporal total (TBW), un indicador de la masa celular corporal inferior. Por lo tanto, un aumento en ECW/TBW puede explicarse por desnutrición o pérdida de masa muscular esquelética, así como por estado de sobrecarga de líquidos.
Nuestros hallazgos también demostraron que un PA más bajo tendía a tener una relación ECW/TBW significativamente más alta entre los pacientes con HD. Además, un PA bajo mostró una tendencia a asociarse con un IMC más bajo, fuerza de prensión manual y niveles más altos de ECW-TBW y proteína C reactiva, que se incluyen en los criterios de diagnóstico de fragilidad o PEW y fueron consistentes con los resultados de estudios previos.
Igualmente, un PA más bajo se correlacionó con PEW, el OR más alto en los modelos multivariantes fue 10,967 y 11,099 en el grupo del primer cuartil en comparación con el grupo de referencia (grupo del cuarto cuartil).
Ruperto et al. posteriormente confirmó que PA < 4° era un predictor de riesgo independiente para pacientes en HD con PEW , y está en línea con nuestros resultados. Por lo tanto, también reconocimos que un PA bajo era un indicador importante de desnutrición e hidratación en pacientes en HD. Además, se demostró en este estudio que un PA bajo se asoció con un TBW bajo como indicador de la masa muscular esquelética en pacientes en HD.
Además, el PA bajo fue un factor de riesgo mayor para la fragilidad incluso después de ajustar por otros indicadores clínicos. Varios estudios previos han informado una asociación entre un PA bajo y el fenómeno de fragilidad en sujetos mayores o pacientes de cirugía cardiaca aunque muy pocos estudios se han centrado en pacientes en HD.
En el presente estudio, también se determinó que el PA bajo es un biomarcador integral representativo de la desnutrición, la fragilidad y la hidratación en pacientes con HD.
Pocos estudios han evaluado la asociación entre AP y mortalidad o evento CV en pacientes en HD.
Más recientemente, Bansal et al. y Segall et al. demostraron que el PA se asoció significativamente con la mortalidad en pacientes con ERC y pacientes con HD .
Varan et al. informaron un aumento significativo en el riesgo de muerte entre pacientes en HD con PA < 4°, incluso después del ajuste de varios indicadores nutricionales .
En el presente estudio, el grupo del primer cuartil (PA < 3,7°) tenía una puntuación de riesgo CV significativamente mayor en comparación con los grupos del tercer cuartil (PA 4,2–4,9°) y del cuarto cuartil (PA ≥ 5,0°). Sin embargo, dado el número relativamente pequeño de pacientes y los pocos eventos en el presente estudio, no se pudieron analizar los factores relacionados con la mortalidad por todas las causas o la incidencia de eventos CV.
Por lo tanto, este estudio propone que la detección periódica sería esencial para controlar la progresión de la PEW o la fragilidad a lo largo del tiempo y para evitar el desarrollo del círculo vicioso de la PEW o la fragilidad.
La detección periódica puede ayudar en la identificación temprana de pacientes acompañados de PEW o fragilidad cuando son los más tratables, así como proporcionar información pronóstica.
Por lo tanto, este studio sugiere que el PA podría ser un indicador simple y útil para predecir el riesgo de PEW, fragilidad y eventos CV entre los pacientes en HD.
Conclusiones
Un PA más bajo se asoció con un mayor riesgo de PEW y fragilidad en pacientes en hemodiálisis con lo cual el PA podría ser un indicador simple y útil para predecir PEW y fragilidad entre los pacientes en HD
Limitaciones del estudio
1-Los hallazgos del estudio se limitan a un número relativamente pequeño de pacientes en un solo centro de HD, aunque la mayoría de los resultados son comparables con los de estudios clínicos anteriores.
2-No se pudo evaluar la relación entre el ángulo de fase y la gravedad de la PEW, incluida la caquexia por enfermedad renal.
Futuras investigaciones deben evaluar la precisión diagnóstica, pronóstica y predictiva del ángulo de fase en el estado de caquexia de enfermedad renal o PEW grave.
Referencias
1-Kim JC, Kalantar-Zadeh K, Kopple JD. Frailty and protein-energy wasting in elderly patients with end stage kidney disease. J Am Soc Nephrol. 2013; 24(3):337–51.
2-Matsubara Y, Kimachi M, Fukuma S, Onishi Y, Fukuhara S. Development of a new risk model for predicting cardiovascular events among hemodialysis patients: population-based hemodialysis patients from the Japan dialysis outcome and practice patterns study (J-OPPS). PLoS One. 2017;12(3): e0173468.
3-Bosy-Westphal A, Schautz B, Later W, Kehayias JJ, Gallagher D, Müller MJ. What makes a BIA equation unique? Validity of eight-electrode multifrequency BIA to estimate body composition in a healthy adult population. Eur J Clin Nutr. 2013;67(Suppl 1):S14–21.
4-Woodrow G. Extracellular water expansion: part of the malnutritioninflammation-atherosclerosis syndrome? Perit Dial Int. 2006;26(5):566–70.
5-Tan RS, Liang DH, Liu Y, Zhong XS, Zhang DS, Ma J. Bioelectrical impedance analysis–derived phase angle predicts protein–energy wasting in maintenance hemodialysis patients. J Ren Nutr. 2019;29(4):295–301.
6-Mullie L, Obrand A, Bendayan M, Trnkus OMC, Moss E, et al. Phase angle as a biomarker for frailty and postoperative mortality: the BICS study. J Am Heart Assoc. 2018;7(17):e008721.
7-Varan HD, Bolayir B, Kara O, Arik G, Kizilarslanoglu MC, Kilic MK, et al. Phase angle assessment by bioelectrical impedance analysis and its predictive value for malnutrition risk in hospitalized geriatric patients. Aging Clin Exp Res. 2016;28(6):1121–6.
Predicational ability of phase angle on protein energy wasting in kidney disease patients with renal replacement therapy: A cross-sectional study Haiteng Zhou1 | Wenlong Yao2 | Da Pan1 | Guiju Sun1
Capacidad predictiva del ángulo de fase sobre la pérdida de energía proteica en pacientes con enfermedad renal con terapia de reemplazo renal: un estudio transversal
Autores: Haiteng Zhou; Wenlong Yao; Da Pan; Guiju Sun
Food Sci Nutr. 2021;9:3573–3579.
Justificación
Entre las complicaciones de la ERC, la pérdida de energía proteica (DPE) es un problema frecuente, y esta desnutrición reduce la calidad de vida de los pacientes, aumenta el consumo de recursos sanitarios e implica mayores costes médicos, al incrementar el riesgo de mortalidad (Bonanni et al., 2011 ; Chao et al., 2017).
Un metanálisis mostró que la prevalencia de DPE entre 30 países fue del 28% al 54% (Carrero et al., 2018).
En el estudio transversal de As'habi, la prevalencia de DPE en pacientes en diálisis peritoneal fue del 29% (As'Habi et al., 2019).
En el estudio de Lydia Namuyimbwa, la prevalencia de DPE fue del 47,3 % en los sujetos con ERC y significativamente mayor que la de aquellos sin ERC (21,3 %; Vermeulen, Lopes, Grilo, et al., 2019 ).
Dado que la prevalencia de DPE tiene un gran impacto en la calidad de vida y los tratamientos de la ERC, su diagnóstico y la intervención tempranos beneficiarían la situación de salud y reducirían el costo y la carga médica (Chao et al., 2017).
En el diagnóstico de la DPE, los criterios de la Sociedad Internacional de Nutrición y Metabolismo Renales (ISRNM) recomiendan que la química sérica, la masa corporal, la masa muscular y la ingesta dietética puedan considerarse indicadores para el diagnóstico de DPE (Carrero et al., 2013).
El criterio es que, si están presentes tres características (niveles séricos bajos de albúmina , masa corporal reducida y masa muscular reducida), se podría diagnosticar el DPE.
Otros biomarcadores como proteína C reactiva (hsCRP), log IL-6, molécula de adhesión intercelular soluble-1 (sICAM-1), gelsolina, adipoquinas, niveles de leptina sérica, creatinina sérica y TNF-alfa también se usaron para diagnosticar PEW (Chiu et al., 2015 ; Choi et al., 2010).
En el estudio de Arias-Guillén, se utilizó la espectroscopia de bioimpedancia para detectar DPE, y los resultados mostraron que podría usarse como un instrumento práctico para evaluar el estado nutricional en pacientes utilizando la composición corporal (Arias-Guillén et al., 2018 ).
Srinivasan Beddhu y Castellano-Gasch también recomendaron que la composición corporal fuera válida en el diagnóstico de DPE (Beddhu et al., 2017 ; Castellano-Gasch et al., 2014 ).
El ángulo de fase (PA) podría usarse en la evaluación de la evaluación nutricional, la función muscular y la diabetes tipo 2 (Chen & Zhou, 2019 ; Dittmar et al., 2015 ; Player et al., 2019 ; Yamada et al., 2018 ).
El estudio de Yoshida indicó que los pacientes con discapacidad motora e intelectual severa tienen un valor de PA y ECW/TBW (agua extracelular/agua corporal total) más bajo (Yoshida et al., 2017 ).
Además del PA, la circunferencia media del brazo (CAM) y la composición corporal también podrían usarse como indicadores para el diagnóstico de DPE en pacientes con tratamiento renal sustitutivo (TRR) (Krishnamoorthy et al., 2015 ; Leal Escobar et al., 2019 ; Powrózek et al., 2019 ; Shin et al., 2017 ).
Los estudios sobre la capacidad del PA, MAC y composiciones corporales relacionadas en el diagnóstico no invasivo de DPE son muy valiosos.
El presente estudio tuvo como objetivo investigar la capacidad predictiva del PA y la composición corporal en el diagnóstico de PEW en pacientes con TRR.
Métodos
Los datos se recopilaron entre enero de 2018 y junio de 2019 en el Hospital Popular de Jingjiang, provincia de Jiangsu, China.
Los criterios y categorías para DPE se referían a los criterios de diagnóstico de ISRNM, y el diagnóstico de DPE era al menos 3 de los indicadores y una prueba bioquímica que se presentan a continuación:
(a) niveles séricos de albúmina inferiores a 3,8 g/dl o colesterol total < 100mg/dl;
(b) IMC inferior a 23 kg/m 2 ;
(c) Un índice de masa libre de grasa (FFMI) inferior a 17,0 kg/m2 o 15,0 kg/m2 para hombres y mujeres según definiciones de The European Society of Clinical Nutrition and Metabolism (ESPEN; Cederholm et al., 2015 );
(d)sobrehidratación (ECW/TBW >0.385), que se correlaciona con el estado de inflamación y la manifestación subclínica en pacientes con CKD (Lee et al., 2015 ; Panorchan & Davenport, 2017 ; Sasaki & Al, 2008 ).
Recopilación de datos
Se utilizó tecnología de impedancia bioeléctrica multifrecuencia segmentada directa para analizar la composición corporal (InBody ® modelo 770).
Todos los pacientes que terminaron el tratamiento de hemodiafiltración eran remitidos a análisis de composición corporal obteniéndose los parámetros de : peso, MAC, WC, masa grasa (%), FFM, ECW y TBW.
El PA se obtuvo a una frecuencia de 50 Hz.
La talla se midió con tallímetro (InBody ® modelo BSM 170), y se calculó la masa libre de grasa (FFMI) y el IMC.
Análisis estadísticos
Los datos de distribución normal se presentaron como media ± DE , y las variables numéricas no normales se presentaron por mediana y distancia intercuartil. Se utilizó la prueba de la t de Student o la prueba exacta de Fisher para analizar la diferencia entre los grupos;
Se utilizó la correlación de rangos de Spearman entre la composición corporal y las variables bioquímicas con MAC y PA.
Usando una curva característica operativa del receptor (ROC) y el área bajo la curva (AUC), se calcularon los valores de corte.
Con los valores de corte óptimos de la ROC, se realizó un análisis de chi-cuadrado y se calcularon la razón de probabilidades y el intervalo de confianza del 95 % (IC del 95 %). Se consideró estadísticamente significativo un valor de p < 0,05.
Resultados
Sesenta y cuatro pacientes participaron en este estudio, treinta y tres (52,6%) eran hombres y la edad promedio era de sesenta años.
Cuarenta (62,5%) pacientes fueron diagnosticados como DPE y más del 60% de los pacientes tienen síntomas de edema.
Los parámetros demográficos y de composición corporal del paciente se muestran en la Tabla 1 .
.png)
De acuerdo con el diagnóstico expresado anteriormente, los pacientes se dividieron en grupos DPE y no DPE.
Los pacientes sin DPE tienen un menor peso ( p = 0,012). En comparación con el grupo DPE, MAC ( p = 0,008), colesterol ( p < 0,01), concentración de albúmina ( p = 0,004) y PA ( p < 0,01) fueron significativamente más altos en el grupo sin PEW.
La creatinina en suero, BUN en suero y ECW/TBW no mostraron diferencias estadísticamente significativas entre los grupos ( p < 0,05; Tabla 2 ).
.png)
Se analizaron las correlaciones de la composición corporal y las variables bioquímicas con la circunferencia del brazo medio y el ángulo de fase (Tabla 3 ).
.png)
La MAC ( R = .516, p < .01) y WC ( R = .346, p = .005) se correlacionó positivamente con el PA, mientras que EW/TBW ( R = −.5, p < .01) se correlacionó negativamente.
El ángulo de fase (R = 0,516, p < 0,01), el IMC ( R = 0,466, p < 0,01) y la circunferencia de la cintura (R = 0,889, p < 0,01) se correlacionaron positivamente con MAC, mientras que la albúmina (R = −0,426, pag < .01) y ECW/TBW ( R = −.357, p < .004) se correlacionaron negativamente con MAC, respectivamente.
Los indicadores de composición corporal destacaron en el diagnóstico de DPE en pacientes con TRR (Figura 1).
.png)
Los puntos de corte AUC y premium para PA, MAC, FFMI, BMI y WC fueron 0,749°, 0,668°, 0,691°, 0,783°, 0,690° y 4,45°, 29,7 cm, 19,71, 21,1, 86,4 cm, respectivamente. El AUC de PA y el IMC superiores a 0,7 revelaron una gran capacidad de diagnóstico de DPE en pacientes con TRR (Tabla 4 ).
.png)
Con base en los puntos de corte ROC, se realizó la prueba de chi-cuadrado entre los grupos DPE y no DPE, y se calcularon OR (odds ratio) e IC del 95% (intervalo de confianza del 95%).
Los puntos de corte de PA < 4,45° (OR = 6,333, p = ,002), MAC < 29,7 cm (OR = 3,267, p = ,036), IMC < 21,1 kg/m 2 (OR = 28,111, p < ,01 ) y CC <86,4 cm (OR = 7,933, p = 0,001) se identificaron como de alto riesgo para DPE (Tabla 5 ).
.png)
Discusión
El análisis de impedancia bioeléctrica es una técnica simple, no invasiva y confiable para la estimación de la composición corporal y se ha utilizado en el diagnóstico de enfermedades como la diabetes tipo 2, la disfunción muscular, la hidratación y la evaluación nutricional (Dittmar et al., 2015 ; Norman et al. al., 2012 ; Vermeulen, Lopes, Grilo et al., 2019).
En pacientes con ERC, la desnutrición ha sido ampliamente reconocida y la manifestación es DPE.
Detectar y manejar el estado nutricional sería beneficioso para el tratamiento de los pacientes y disminuiría la mortalidad (Bataille et al., 2019; Bolasco et al., 2019).
El BUN y la creatinina están relacionados con la función renal y condicionalmente con el estado nutricional.
En este estudio, BUN/Cr estaba por debajo de 20 y no hubo diferencia entre los grupos DPE y no DPE. Dado que la creatinina se ve afectada por la ingesta de proteínas en la dieta, este resultado puede ser inexacto (Singh et al., 2015 ).
Los estudios preliminares informaron que el envejecimiento se asoció con la prevalencia de la ERC (56,4 años en Henan China Duan et al., 2019 y 57,2 años en el norte de Sri Lanka Ranasinghe et al., 2019), y esta tendencia de envejecimiento también se reconoció en nuestro estudio (la edad media fue de 59,6 años).
Cuarenta (62,5%) pacientes fueron diagnosticados con DPE en el presente estudio, que fue más alto que estudios similares en cuanto a la influencia del envejecimiento (Bi et al., 2019; Gracia-Iguacel et al., 2019 ; Hara et al., 2018).
Se podrían utilizar muchos indicadores para determinar el DPE, como las definiciones de ISRNM y ESPEN a las que nos referimos.
Además de la evaluación dietética, la puntuación DPE, los biomarcadores del índice de riesgo nutricional geriátrico y los índices de composición corporal también se informaron en el diagnóstico de DPE (Ishii et al., 2017 ; Lee et al., 2019 ; Monzani et al., 2018).
En el presente estudio, se evaluó la capacidad de la composición corporal, especialmente PA y MAC, en el diagnóstico de DPE en pacientes con ERC.
Según el análisis ROC, se recomienda que los pacientes con PA inferior a 4,46 grados tengan un mayor riesgo de DPE (AUC = 0,749, sensibilidad + especificidad = 120,8 %). El valor de corte fue similar al del estudio de Jung-ho Shin (PA <4,5°; Shin et al., 2017).
También se analizó la capacidad de MAC, WC, BMI y FFMI en el diagnóstico de DPE y recomendamos que el valor de corte de la prima fuera de 29,7 cm, 86,4 cm, 21,1 kg/m 2 y 16,71 kg/m 2 , respectivamente.
El AUC demostró que el IMC tiene una mejor capacidad para el diagnóstico de DPE, que fue un indicador recomendado por ISRNM, ESPEN y SGA (Vermeulen, Lopes, Alves, et al., 2019 ) (evaluación global subjetiva).
El punto de corte del IMC en este estudio fue de 21,1 kg/m 2, y Windahl encontraron que el PEW era el más común en pacientes con IMC <22 kg/m 2 (Windahl et al.,2018 ).
Se realizó la correlación entre la composición corporal y los biomarcadores.
MAC (R = .516, p < .01) y WC (R = .346, p = .005) se correlacionaron positivamente con PA, mientras que EW/TBW (R = −.5, p < .01) se correlacionó negativamente. se correlacionó con el PA , que se asoció con la gravedad del estado nutricional, y se obtuvo un resultado consistente en el estudio de Yoshida, M.
El ángulo de fase (R = .516, p < .01), IMC (R = .466, p < .01) y la circunferencia de la cintura (R = .889, p < .01) se correlacionaron positivamente con MAC, mientras que la albúmina (R = -.426, p < .01) y EW/TBW (R = -0.357, p < .004) se correlacionaron negativamente con MAC, respectivamente (Krishnamoorthy et al., 2015 ; Tan et al., 2019).
Considerando M-BIA como predictor en la evaluación de la salud en poblaciones (Norman et al., 2012 ; Powrózek et al., 2019 ; Vermeulen, Lopes, Alves et al., 2019), nuestro los resultados de este estudio también indicaron que el PA puede ser utilizado como factor independiente asociado a la desnutrición en pacientes con ERC.
Karavetian et al. (2019) según los puntos de corte ROC, realizaron la prueba de Chi-cuadrado entre los grupos DPE y no DPE.
OR y 95% CI se calcularon en la predicción de DPE.
Un PA menor de 4,46 grados se asoció con la prevalencia de DPE (OR = 6,333, IC 95% 1,950-20,505). Tan et al. ( 2019 ).
De igual forma, CAM <29,7 CM (OR = 3,267, IC 95% 1,136–9,394), IMC <21,1 kg/m 2 (OR = 28,111, IC 95% 3,418–228,823) y CC <86,4 cm (OR = 7.933, IC 95% 2.418-26.030) se asociaron a un mayor riesgo para la incidencia de DPE.
Limitaciones
Se reclutaron pacientes con ERC en TRR, y la edad promedio fue cercana a los 60 años; por lo tanto, los resultados no pueden extrapolarse a otros pacientes en diferentes tratamientos y otros grupos de edad.
Por otra parte: el tamaño de la muestra es limitado debido a que los pacientes reclutados eran de un solo hospital dentro del tiempo establecido.
Conclusiones
En los pacientes mayores de TRR, más del 60% de los pacientes fueron diagnosticados con DPE.
El PA y la MAC se pueden usar como indicadores independientes y confiables para la predicción no invasiva de DPE y la evaluación del estado nutricional en pacientes con ERC que envejecen en TRR.
Referencias
1-Arias-Guillén, M., Perez, E., Herrera, P., Romano, B., Ojeda, R., Vera, M., Ríos, J., Fontseré, N., & Maduell, F. (2018). Bioimpedance spectroscopy as a practical tool for the early detection and prevention of protein-energy wasting in hemodialysis patients. Journal of Renal Nutrition, 28(5), 324–332.
2-Bi, X., Chu, M., Ai, H., Hu, C., & Ding, W. (2019). Association of serum IL-18 with protein-energy wasting in end-stage renal disease patients on haemodialysis. International Urology and Nephrology, 51(7), 1271–1278.
3-Carrero, J. J., Stenvinkel, P., Cuppari, L., Ikizler, T. A., Kalantar-Zadeh, K., Kaysen, G., Mitch, W. E., Price, S. R., Wanner, C., Wang, A. Y. M., ter Wee, P., & Franch, H. A. (2013). Etiology of the protein-energy wasting syndrome in chronic kidney disease: A consensus statement from the International Society of Renal Nutrition and Metabolism (ISRNM). Journal of Renal Nutrition, 23(2), 77–90.
4-Herrera Valdés, R., Almaguer López, M., Chipi Cabrera, J. A., Pérez-Oliva Díaz, J. F., Landrove Rodríguez, O., & Mármol Sóñora, A. (2020). Prevalence and incidence of chronic kidney disease in Cuba. Clinical Nephrology. 93, 68–71.
5-Lee, S. W., Kim, Y.-S., Kim, Y. H., Chung, W., Park, S. K., Choi, K. H., Ahn, C., & Oh, K.-H. (2019). Dietary protein intake, protein energy wasting, and the progression of chronic kidney disease: Analysis from the KNOW-CKD study. Nutrients, 11(1), 121.
6-Panorchan, K., & Davenport, A. (2017). Increase in extracellular hydration status after initiating peritoneal dialysis electively. Peritoneal Dialysis International: Journal of the International Society for Peritoneal Dialysis, 37(3), 338–340.
7-Singh, N., Fallahzadeh, M. K., & Abreo, K. (2015). Effect of increased dietary protein intake on the 24-hour urine creatinine clearance and eligibility of living kidney donor candidates. Experimental and Clinical Transplantation: Official Journal of the Middle East Society for Organ Transplantation, 13(6), 609–610.
8-Windahl, K., Faxén Irving, G., Almquist, T., Lidén, M. K., van de Luijtgaarden, M., Chesnaye, N. C., Voskamp, P., Stenvinkel, P., Klinger, M., Szymczak, M., Torino, C., Postorini, M., Drechsler, C., Caskey, F. J., Wanner, C., Dekker, F. W., Jager, K. J., & Evans, M. (2018). Prevalence and risk of protein-energy wasting assessed by subjective global assessment in older adults with advanced chronic kidney disease: results from the EQUAL study. Journal of Renal Nutrition, 28(3), 165–174.
9-Zhou, M., Wang, H., Zeng, X., Yin, P., Zhu, J., Chen, W., Li, X., Wang, L., Wang, L., Liu, Y., Liu, J., Zhang, M., Qi, J., Yu, S., Afshin, A., Gakidou, E., Glenn, S., Krish, V. S., Miller-Petrie, M. K., … Liang, X. (2019). Mortality, morbidity, and risk factors in China and its provinces, 1990–2017: A systematic analysis for the Global Burden of Disease Study 2017. The Lancet, 394(10204), 1145–1158.